
DISOCIEREA SUBSTANTELOR SI REACTII CHIMICE SPECIFICE IN SPATIUL ARCULUI ELECTRIC
Vaporii si gazele care ajung in spatiul arcului electric sufera un inalt grad de disociere datorita temperaturilor inalte la care sunt incalzite. Astfel gazele biatomice H2, O2, N2, F2 disociaza dupa ecuatia 2A A2 (3.45), pe cand substantele cu o complexitate mai avansata H2O, CO2, Na2CO3, etc., disociaza dupa reactii multiple specifice fiecarei substante. Daca notam cu η numarul de elemente ale substantei care disociaza si cu a, gradul de disociere (raportul dintre numarul de molecule disociate si numarul total de molecule ale substantei), pentru fiecare grup de substante si pentru fiecare tip de reactie de disociere, se pot face unele observatii.
1. Disocierea gazelor biatomice
Intrucat gazele biatomice au o singura posibilitate de disociere aratata de reactia 3.45, rezulta ca din n molecule de gaz, vor disocia na molecule, formand 2na atomi si vor ramane n(1- a) molecule nedisociate. Numarul total de particule rezultate va fi: 2na + n(1 - a) = n(1 + a
Notand cu P0 presiunea totala a gazului, cu PM presiunea partiala a gazului format din molecule nedisociate si cu PA, presiunea partiala a gazului format din atomii rezultati din disociere, se poate scrie:
![]() (3.46)
(3.46)
![]() (3.47)
(3.47)
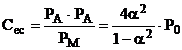 (3.48)
(3.48)
Din relatia
3.48 se poate calcula gradul de disociere a in functie de presiunea P0
si de
![]() (3.49)
(3.49)
Analizand datele prezentate in tabelul 3.6 si calculand a pentru gazele biatomice F2, H2, O2 si N2, se observa ca hidrogenul, oxigenul si fluorul sunt practic complet disociate la temperatura arcului, pe cand azotul are un grad redus de disociere.
Tabelul 3.6 Constantele de echilibru Cec si gradul de disociere α pentru gazele biatomice F2, H2, O2 si N2
|
Temperatura [K] |
2F |
2H |
20 |
2N |
||||
|
log Cec |
log Cec |
log Cec |
log Cec | |||||
|
| ||||||||
Astfel gradul de disociere al azotului la temperatura T = 5000 K este a = 26,4%, deci azotul are molecula mai stabila decat celelalte gaze, ceea ce rezulta si din energia absorbita pentru reactie, care are cea mai mare valoare.
2. Disocierea apei
Vaporii de apa care ajung in spatiul arcului electric provin din invelisul electrozilor, respectiv din fluxul de sudare, din impuritatile existente pe suprafata piesei (substante organice, rugina, etc.) sau din umiditatea atmosferica. Acessti vapori disociaza in spatiul arcului electric dupa una din urmatoarele reactii:
2H2 + O2 = 2H2O + 483,8 kJ (3.50)
2OH + H2 = 2H2O + 533,6 kJ (3.51)
4H + O2 = 2H2O + 1352,7 kJ (3.52)
2H2 + 2O = 2H2O + 1397,1 kJ (3.53)
4H + 2O = 2H2O + 1805,6 kJ (3.54)
In cazul temperaturilor corespunzatoare sudarii cu arc electric, cele mai probabile reactii sunt (3.50) si (3.51), iar la temperaturi mai mari, corespunzatoare arcului sau jetului de plasma, reactiile cu probabilitate maxima sunt (3.52), (3.53) sau (3.59)
Pentru reactiile de tipul (3.50) si (3.51) din doua molecule de apa (2n) rezulta 3 particule. Considerand a gradul de disociere se obtine un numar total de 3an particule si raman 2(1 -a)n molecule nedisociate.
Presiunile partiale ale particulelor vor fi:
pentru
relatia 3.50 ![]() (3.55)
(3.55)
pentru
relatia 3.51 ![]() (3.56)
(3.56)
Constantele de echilibru ale reactiilor respective vor fi:
 (3.57)
(3.57)
Prin inlocuirea
presiunilor partiale ale particulelor corespunzatoare reactiilor
3.50 si 3.51 se obtine acceasi
 (3.58)
(3.58)
Gradul de disociere al vaporilor de apa se poate calcula in functie de presiune si de constantele de echilibru Cec1 pentru relatia 3.50, respectiv Cec2 pentru reactia 3.51, cu ajutorul relatiei 3.58.
In tabelul 3.7 se dau valorile constantelor de echilibru Cec1 si Cec2 in functie de temperatura.
Tabelul 3.7 Constantele de echilibru Cec1 si Cec2 pentru relatiile 3.50 respectiv 3.51 in functie de temperatura
T [K] | ||||||||||||
|
log Cec1 | ||||||||||||
|
log Cec2 |
Comparand datele din acest tabel se observa ca la T = 1600 K constantele de echilibru sunt egale, deci relatiile 3.50 si 3.51 afecteaza in mod egal numarul de molecule disociate.
La temperaturile arcului electric care depasesc net valoarea T = 1600 K, se observa din tabelul 3.7 ca
Cec2 > Cec1, deci disocierile dupa reactia 3.51 sunt mai numeroase decat disocierile dupa reactia 3.50.
In realitate, in spatiul arcului electric se produc si reactii chimice care maresc sau micsoreaza numarul unor atomi cu reactivitate sau solubilitate sporita, ceea ce influenteaza echilibrul disocierilor.
3. Disocierea sau formarea oxizilor
In spatiul arcului electric se gaseste oxigen provenind fie din disocierea unor oxizi, fie din disocierea apei.
De obicei, intre oxigen si elementul E cu cea mai mare afinitate chimica, existent in spatiul arcului electric, se produce reactia
E + O EO + n J (3.59)
a carei
Pentru exemplificare, se considera ca elementul chimic din reactia (3.59) este un metal bivalent, iar oxigenul necesar formarii oxidului, provine din reactia 3.50. In concordanta cu legea energiei libere minime, reactia 3.50 este prima reactie probabila din care rezulta oxigen.
In acest caz reactia 3.59 devine:
2Me + O2 2MeO (3.60)
iar
 (3.61).
(3.61).
Din relatia 3.61 se poate calcula presiunea partiala a oxigenului, care reactioneaza cu metalul.
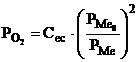 (3.62)
(3.62)
Intrucat acest
oxigen provine din relatia 3.50 el va avea o presiune partiala,
care rezulta din relatia 3.57 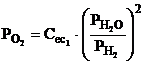 (3.63)
(3.63)
In realitate reactiile 3.50 si 3.60 au loc concomitent in spatiul arcului electric, iar metalul Me reactioneaza cu oxigenul provenit din vaporii de apa in prezenta oxigenului dat de relatia 3.62, care este reducator. Daca valoarea presiunii partiale a oxigenului dat de relatia 3.62 este mai mica decat valoarea data de relatia 3.63, rezulta un exces de oxigen provenit din descompunerea apei, care favorizeaza reactia:
Me + H2O MeO + H2 (3.64)
In caz contrar, rezulta o lipsa de oxigen provenit din descompunerea apei si reactia are sens invers:
Me + H2O MeO + H2 (3.65)
Se observa ca in anumite conditii de presiune si temperatura, vaporii de apa existenti in spatiul arcului electric pot avea un caracter oxidant (reactia 3.64), sau un caracter reducator (reactia 3.65).
O alta varianta a reactiei 3.59 este reactia oxigenului, provenit din disocierea vaporilor de apa (reactia 3.50) cu metaloidele din spatiul arcului electric.
In cazul carbonului, reactia devine
C + H2O CO + H2 (3.66)
si in functie de sensul reactiei, in baia metalica poate avea loc o decarburare (scaderea continutului de carbon) sau o carburare (cresterea continutului de carbon).
Explicatia sensului relatiei 3.66 se poate da in mod similar cu explicarea sensului relatiilor 3.64, respectiv 3.65.
4. Disocierea carbonatilor
Carbonatul de calciu este o substanta des intalnita in invelisul electrozilor sau in fluxurile pentru sudare. Disocierea lui incepe la temperaturi relativ joase, iar la 900 - 920 oC aceasta este energica si rezulta:
CaCO3 CaO + CO2 - 177,9 kJ (3.67)
Produsele rezultate din aceasta reactie nu au rol favorabil asupra proceselor care se desfasoara la nivelul spatiului dintre electrozi. Astfel, calciul avand o tensiune de ionizare redusa, favorizeaza stabilitatea arcului electric, iar oxidul de calciu are rolul protector asupra metalului topit.
Bioxidul de carbon degajat din aceasta reactie, creaza o suprapresiune in spatiul arcului electric si impiedica intrarea aerului. Bioxidul de carbon disociaza la randul sau in oxigen si CO, deci este oxidant si favorizeaza reactiile de oxidare. Disocierea bioxidului de carbon decurge dupa urmatoarea reactie:
2CO + O2 2CO2 + 566,2 kJ (3.68)
Si in cazul
acestei reactii se poate exprima
Tabelul 3.8 Valorile constantei de echilibru a reactiei 2 CO + O2 2 CO2 + 135,3 kcal
|
T [K] |
| |||||||||||
|
log Cec |
Cunoscandu-se
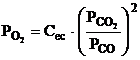 (3.69)
(3.69)
In legatura cu presiunea acestui oxigen si presiunea oxigenului dat de relatia 3.62 se pot face aceleasi observatii ca si la punctul 3.23 asupra sensului reactiei:
MeO + CO Me + CO2 (3.70)
Astfel, in cazul valorilor mai mari ale presiunii oxigenului din relatia 3.69 fata de presiunea oxigenului din relatia 3.62 (in cazul unui exces de oxigen provenit din disocierea CO2), are loc oxidarea metalului Me, iar in caz contrar are loc reducerea oxizilor metalic MeO. Rezulta ca si bioxidul de carbon, la fel ca si vaporii de apa, poate avea un rol protector , al unor elemente chimice din spatiul arcului electric.
Un caz particular al efectului reducator al bioxidului de carbon, se observa la sudarea otelurilor cu continut foarte redus de carbon (oteluri ionxidabile, oteluri maraging, etc.), la care are loc o carburare a baii metalice , prin carbonul provenit din CO2. Acest efect nedorit se poate compensa prin adaosurile de Fe2O3, NiO, ZrO2, Cr2O3 din invelisul bazic al electrozilor destinati sudarii acestor oteluri.
5. Disocierea oxidului de azot
Azotul patrunde in spatiul arcului electric din atmosfera inconjuratoare sau din diferiti componenti care participa la formarea baii metalice si se oxideaza datorita temperaturilor inalte din arc.
N2 + O2 2NO - 180,8 kJ (3.71)
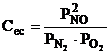 (3.72)
(3.72)
iar valorile ei in functie de temperatura sunt date in tabelul 3.9.
Tabelul 3.9 Constanta de echilibru a reactiei de formare a oxidului de azot (3.71)
|
T [K] | ||||||||||
|
log Ce |
Dupa cum se
observa din tabelul 3.9, la temperaturile inalte,
In prezenta metalului topit, oxidul de azot este un oxidant mult mai activ, decat oxigenul pur
2 Me + NO MeO + N2 (3.73)
Azotul rezultat din aceasta reactie se dizolva in metalul lichid si formeaza combinatii chimice cu carbonul si hidrogenul sau formeaza cu componentii metalici nitruri fragile.
Reactia 3.73 explica de ce azotul din spatiul arcului electric, in prezenta oxigenului, este mult mai activ, decat atunci cand oxigenul lipseste.
6. Reactii dintre faza lichida si faza gazoasa. Formarea porilor in metalul depus prin sudare
Reactiile si calculele prezentate pana la acest subpunct s-au referit la cazul in care diferitele substante din arcul electric se gasesc in stare vaporizata (gazoasa). In realitate, in paralel cu substantele gazoase, in spatiul arcului electric se gasesc si substante lichide, motiv pentru care modul de desfasurare a reactiilor se deosebeste fata de cel prezentat anterior. Astfel reactia 3.60, in care metalul si oxidul se gasesc sub forma de faze lichide (indicele L)
2MeL + O2 2 (MeO)L (3.74)
are
PMe = PMeO
deci Cec = ![]() (3.75)
(3.75)
Energia libera a reactiei (3.74) este:
DE = -R . T ln![]() (3.76)
(3.76)
in care R = 8,313
J/mol . K este
Intrucat ![]() este o functie de
temperatura, rezulta ca si DE depinde numai de temperatura.
este o functie de
temperatura, rezulta ca si DE depinde numai de temperatura.
In tabelul 3.10 sunt prezentate caracteristicile unor reactii de oxidare a metalelor, mai des intalnite in tehnica.
Tabelul 3.10 Reactii de oxidare a unor metale tehnice
|
Ecuatia reactiei |
Log P0 pentru temperaturile [K] |
||||
|
4Cu +O2 Cu2O | |||||
|
2Ni + O2 2NiO | |||||
|
2Mo + 3O2 2MoO3 | |||||
|
2Fe + O2 2FeO | |||||
|
2W + 3O2 2WO3 | |||||
|
4Cr + 3O2 2Cr2O3 | |||||
|
2Mn + O2 2MnO | |||||
|
Si + O2 SiO2 | |||||
|
Ti + O2 TiO2 | |||||
|
4Al +3O2 2Al2O3 | |||||
|
2Ca + O2 2CaO | |||||
Relatia 3.75 este adevarata atat timp cat oxidul metalic (MeO)L format prin reactia 3.74 nu se dizolva in metalul lichid MeL.
In cazul in care
oxidul (sulfurile, nitrurile, etc.) se dizolva in metalul topit,
 (3.76)
(3.76)
In relatia (3.76) "a" reprezinta gradul de saturatie dat de raportul dintre concentratia reala si concentratia maxima a elementului sau a compusului dizolvat in metalul lichid. Spre exemplu, continutul maxim de FeO in Fe topit, depinde de temperatura
![]() (3.77)
(3.77)
Considerand T = 2000 K rezulta FeOmax = 2,29%, iar
![]() (3.78)
(3.78)
Intrucat Femax = 100%,
![]() (3.79)
(3.79)
Daca FeO variaza de la 0 - 2,29%, Fe variaza de la 100% - 97,71%, ceea ce inseamna practic aFe = 1, pentru care relatia constantei de echilibru (3.76) devine:
 (3.80)
(3.80)
Din aceasta
relatie particularizata pentru Fe si FeO, in comparatie cu
relatia 3.75, se observa ca pentru numai 1% FeO dizolvat in baia
de Fe, constanta de echilibru a reactiei (3.74) se mareste de aproximativ
5,25 ori fata de cazul in care oxizii sunt insolubili. Astfel se
poate afirma ca pentru orice substanta rezultata dintr-o
reactie chimica,
In tabelul 3.11 si in fig. 3.13 sunt prezentate caracteristicile unor compusi mai importanti care apar la sudare.
Tabelul 3.11 Caracteristici fizice a unor compusi
|
Compusul |
FeO* |
Fe3O4 |
|
Cu2O* |
Cu2S* |
Al2O3 |
AlN |
SiO2 |
Ni* |
MgO |
Mg3N2 |
|
Ttopire [sC] |
se descompune |
se descompune |
|||||||||
|
g/cm3 |
Intrucat la sudarea cu arc electric metalele parcurg spatiul arcului sub forma de picaturi lichide la o inalta temperatura si cu o suprafata mare de reactie, vor rezulta reactii chimice energice.
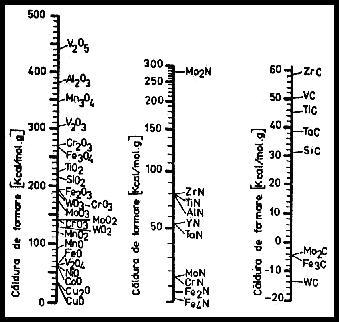
Fig. 3.13 Efectul termic de formare a unor combinatii de elemente
Dupa ce picaturile ajung in baia metalica, datorita micsorarii temperatuilor si a suprafetelor de reactie, intensitatea reactiilor scade.
In realitate reactiile se petrec intr-un timp extrem de redus, asa ca ele nu au timpul necesar de a ajunge la echilibru, ci numai tind catre el.
Reactiile de
oxidare ale unor elemente din baia metalica pot fi diminuate prin
introducerea in spatiul arcului electric a oxizilor unor elemente, sau a
elementelor cu afinitate mai mare pentru oxigen. Astfel existand oxizi in
spatiul de reactie,
Un caz care prezinta interes la sudare este dizolvarea unor gaze in metalul topit, dintre care cele mai importante sunt hidrogenul si azotul.
La temperatura arcului, aceste gaze biatomice si in special hidrogenul, sunt puternic disociate si se dizolva intens in picaturile de metal topit care traverseaza arcul electric (fig. 3.14). Intrucat temperatura baii metalice este mai mica decat temperatura picaturilor, cantitatea de hidrogen dizolvata direct prin suprafata baii este mult mai redusa decat cantitatea de hidrogen dizolvata de picaturi si ajunsa odata cu acestea in baie.
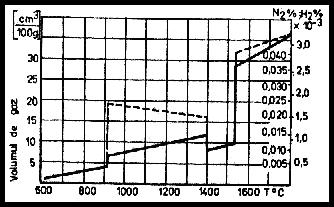
Fig.
3.14 Variatia solubilitatii hidrogenului si azotului in Fe,
in functie de temperatura la o presiune normala ![]()
Variatia brusca a solubilitatii acestor gaze in fier, se observa ca se produce la puncte critice de solidificare, sau de transformare in faza solida.
Prin scaderea brusca a solubilitatii acestor gaze, apar o serie de defecte ale sudarii, printre care se pot aminti: aparitia porilor, fierberea baii metalice si imprastierea stropilor, sau aparitia microfisurilor (fulgi, ochi de peste), etc.
Procesul de aparitie a porilor este favorizat de scaderea solubilitatii gazelor in momentul solidificarii, cand vascozitatea baii metalice este avansata.
Bulele de gaz se formeaza intens la suprafata de separatie dintre cristalele firmate si lichidul ramas. Bulele de gaz pot contine produse chimice gazoase provenite in urma reactiilor chimice sau a reactiilor de recombinare:
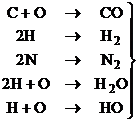 (3.81)
(3.81)
Toate produsele rezultate sunt insolubile in metal, deci tind sa formeze bule de gaze.
Formarea bulelor de gaz este conditionata de raportul presiunii gazelor fata de presiunea exterioara Pe. Aceasta presiune este formata din presiunea atmosferica si presiunile datorita coloanei de metal r h1 (de inaltime h1 si masa specifica r ), datorita coloanei de zgura r h2, precum si datorita tensiunii superficiale a bulei de gaz cu raza r. Conditia de formare a bulei de gaz este: Pg > Pe adica
Pg > Pat + r h1 + r h2 + 2s/r (3.82)
La inceputul
formarii, raza bulei r este redusa si factorul 2s/r are valoare mare si se opune
cresterii acesteia. Spre ex: la oteluri cu s = 1350 dyne/cm, pentru o bula cu r = 5 .
10-5 mm, termenul 2s/r da o presine de 550 at si bula
nu poate creste daca in interiorul ei nu e depasita
aceasta valoare a presiunii. Daca din anumite motive raza bulei r
creste peste o valoare critica rcr, atunci procesul de
crestere a bulei devine tot mai intens in mod accelerat, chiar la presiuni
reduse ale gazului si se formeaza
Defectele
retelei cristaline si eventualele microfisuri de pe suprafata
cristalelor in formare, sunt locuri in care se acumuleaza gaze si in
care pot apare bule de gaze. Daca viteza de separare a acestor bule este
mai redusa decat viteaz de cristalizare, ele raman incluse in metal
sub forma de
Exista mai multe relatii de calcul a cantitatii de gaze dizolvate in fierul pur:
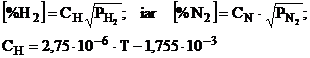 (3.83)
(3.83)
CH = 2,75 . 10-6 . T - 1,755 . 10-3, in care CH, CN, sunt constantele de echilibru care depind de temperatura T (oC), iar PH2, PN2, sunt presiunile partiale ale hidrogenului, respectiv ale azotului care se gasesc sub forma gazoasa in spatiul arcului electric.
Se mai cunosc relatii de calcul a volumului de gaz V ml/100g , dizolvat in 100 g metal.
log VH
= 0,5 log ![]() - 1745/T + 0,888 (3.84)
- 1745/T + 0,888 (3.84)
in care s-au utilizat aceleasi notatii.
In realitate otelul contine in afara fierului si elemente chimice care modifica intens solubilitatea gazelor. Astfel oxigenul are o afinitate mare pentru hidrogen si s-a constatat experimental ca odata cu cresterea oxidului de fier din baie scade contiuntul de hidrogen.
%FeO %H2 (3.85)
Limitarea cantitatii de gaze dizolvate si in special de hidrogen se poate face prin alegerea rationala a substantelor din invelisul electrozilor, prin indepartarea umezelii si a petelor de ulei, vopsea, rugina, etc. de pe metalul de baza, care pot aduce multe gaze in spatiul arcului electric. De asemenea este recomandata reducerea lungimii, respectiv a tensiunii arcului de sudura, pentru a diminua patrunderea azotului in spatiul arcului din atmosfera inconjuratoare.
Astfel, la sudarea otelului cu electrozi fara invelis, daca lungimea arcului se mareste astfel incat tensiunea lui creste de la 18 V la 35 V, atunci cantitatea de azot dizolvata in baie creste si ea de la 0,15 la 0,20%
Relatiile (3.83) - (3.85) prezinta erori de calcul relativ mari in cazul sudarii, intrucat ele sunt precise numai in conditiile de echilibru care niciodata nu sunt atinse la sudare. Chiar si in acesta situatie ele au o importanta teoretica, intrucat indica posibilitatile de influentare a calitatii imbinarilor sudate.
Din aceste relatii se observa ca factorii esentiali care pot fi influentati relativ usor la dizolvarea gazelor in metal, sunt presiunea partiala a gazului, respectiv cantitatea de gaze existenta in spatiul arcului.
Rezulta ca se poate reduce cantitatea de gaze dizolvate in metalul topit inlaturand substantele generatoare de hidrogen si azot sau daca acest lucru este numai partial posibil, se introduc substante care au afinitate ridicata fata de aceste gaze si dau combinatii chimice insolubile in metalul lichid.
Astfel si in cazul combaterii hidrogenului, compusii cei mai favorabili sunt acidul fluorhidric HF si grupul oxihidril OH.
In cazul electrozilor inveliti, hidrogenul din spatiul arcului electric este legat sub forma de HF cu ajutorul tetrafluorurii de siliciu SiF4, care apare la incalzirea unor invelisuri de electrozi (electrozii cu continut redus de hidrogen). Au loc reactiile:
SiF4 + 3H SiF + 3HF
SiF4 + 2H2O SiO2 + 4HF
In cazul sudarii MAG cu atmosfera CO2, CO2 + O2, Ar + CO2, Ar + O2, Ar + CO2 + O2, continutul de hidrogen din sudura este minim datorita, pe de o parte a absentei invelisului (a umezelii continuta de invelis), precum si datorita reactiilor: CO2 + H CO + OH; O + H OH
Asupra formarii porilor un efect deosebit il are azotul. Solubilitatea sa in metalul topit creste intens in prezenta oxidului de azot NO care se formeaza in prezenta oxigenului si are rolul de catalizator. Rezulta ca azotul pur nu este atat de daunator pe cat este amestecul azot-aer, in ceea ce priveste formarea porilor si a nitrurilor fragile.
Astfel, daca se sudeaza cu electrozi neinveliti, in aer si in azot pur, continutul de azot in metalul depus este de 0,22%, respectiv de 0,04% azot. Dizolvarea unei cantitati sporite de azot in metalul topit poate favoriza, la fel ca si hidrogenul, formarea porilor.
Materialele de adaos si atmosferele protectoare, care se folosesc in prezent, sunt astfel concepute si preparate, incat inlatura aceste defecte posibile.
Eventualele defecte care totusi pot apare, reclama nerespectarea unor parametrii tehnologici sau existenta unor surse de impurificare a spatiului arcului electric cu compusi chimici daunatori.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |