SUBSTANTELE CANABINOIDE
Istoria farmaciei pare a fi indisolubil legata de
celebra butada, "aliment = medicament = otrava", exemplele cele mai
cunoscute in acest sens fiind: macul (Papaver
somniferum), ergotul (Claviceps
purpurea), arborele de cafea (Coffea
Arabica). Dupa ce si-a dovedit timp de cateva milenii toxicitatea
si a fost folosita sporadic ca si aliment (semintele),
canepa (in special subspecia
De altfel canepa a fost cunoscuta de catre om, inainte de toate, ca medicament, astfel tratatele medicale chinezesti ce dateaza din epoca imparatului legendar Huang di (acum cca. 4500 ani), recomanda preparatele din canepa in tratamentul durerilor reumatice, migrenelor si constipatiilor, utilizari care nu sunt departe de ceea ce se are in vedere in prezent (18).
Sarind peste cateva milenii de canepa arsa spre deliciul consumatorilor, ajungem la inceputul secolului XIX-lea, cand odata cu dezvoltarea chimiei ca stiinta, cannabisul si alte produse natural intra in vizorul stiintei. Daca in ceea ce priveste alcaloizii, progresele inregistrate vor fi rapide, principiile active din canepa vor ramane elusive multa vreme (18).
Un prim progres notabil a fost izolarea canabinolului, compus cu o usoara actiune psihotropa de catre Todd si Adams la inceputul anilor 1940, dar misterul nu va fi inlaturat decat in 1964 cand se reuseste izolarea si elucidarea structurii moleculare a delta-9 Tetrahidrocanabinol (THC), adevaratul principiu halucinogen al hasisului. THC se regaseste ca ingredient activ in marijuana (sau canabis) fiind consumata in mod recreational, de foarta multa vreme. Chinezii au folosit aceasta planta in urma cu 5000 ani. Canabisul era cultivat pentru fibre si uleiul din seminte. Nu a fost folosit insa pentru efectele sale psihoactive pentru ca perturba echilibrul cerebral cu inducerea de halucinatii. Hindusii au valorificat proprietatile canabisului in tratarea unor boli grave si crearea de "energie vitala" (24).
Abia dupa stabilirea structurii THC au fost sintetizati mai departe analogi ai acestuia. Pana in 1986 mai mult de 300 de derivati de canabinoizi au fost descrisi si analizati pentru a vedea importanta acestora in activitatea psihotropa (24).
Mecanismul de actiune al THC a fost de asemenea controversat. La inceput s-a crezut ca, datorita naturii lipofilice produce perturbari ale membranelor din componenta celulelor.
In 1990, cercetatorii au descoperit receptorii canabinoizi localizati la nivel cerebral si in celulele organismului, responsabili pentru multe din efectele THC (24).
Mecanismul molecular a fost considerat la inceput nespecific, de tip anestezic, pentru acesta pledand lipsa de stereospecificitate a activitatii Delta-9-THC, dar si lipofilitatea sa. Primele dovezi privind actiunea specific a canabinoidelor au fost aduse de Howlett care a aratat ca delta-9-THC inhiba activitatea adenilat-ciclazei in celulele de neuroblastom N18TG2 cultivate in vitro (1984), iar folosirea unui analog radiomarcat, a permis evidentierea de situsuri canabinoidice specifice in creier. Confirmarea acestor fapte a fost adusa de clonarea receptorului canabinoid CB1 si a subtipului periferic CB2 (24).
Receptorii canabinoizi sunt in numar de doi notati CB1 si CB2. CB1 se gaseste in sistemul nervos central iar CB2, descoperit in 1993, este gasit, in principal in celulele sistemului imun (18).
Prezenta receptorilor canabinoizi la mamifere a sugerat existenta unor liganzi endogeni ai acestor receptori. In 1992, a fost izolat primul endocanabinoid denumit anandamida (AEA- arachidonylethanolamida), o amida a etanolaminei cu acidul arahidonic (18).
Ligandul endogen a fost identificat prin separarea cromatografica de fractiuni lipidice din creierul porcin si analizarea lor din punct de vedere al capacitatii de a bloca competitive legarea unui derivat radiomarcat de receptorii canabinoidici. S-a dovedit ca agonistul intern pe acest receptor este un grup de etanolamide ale unor acizi grasi (dihomo γ-linolenic, arahidonic, docosatetraenoic), dintre care cea mai activa este etanolamida acidului arahidonic adica anandamida (de la cuvantul sanscrit "ananda" =fericire) (18).
Trei ani mai tarziu s-a descoperit a doilea endocanabinoid 2-arahidonil-glicerol (2-AG).
Recent a fost izolat un al treilea derivat, un eter, 2-arahidonil gliceril eter, cunoscut și ca noladin eter. Acești compuși lipidici difera total de structura Δ9-Tetrahidrocanabinol (THC), principalul canabinoid exogen (24).
In sistemul nervos central endocanabinoizii se comporta ca si neuromodulatori. In tesuturile periferice non-nervoase, regleaza autocrin sau paracrin homeostazia altor mediatori chimici (24).
Canabinoizii in terapia durerii
Exista la aceasta ora in lumea medicala voci tot mai insistente care solicita forumurilor guvernamentale introducerea canabinoizilor in terapia unor sindroame dureroase cronice. Justificarea acestor cereri vine si prin descrierea la om a repectorilor canabinoizi la nivelul sistemului nervos central si periferic, fara insa sa se poata spuna prea multe despre functionalitatea acestora si liganzii lor endogeni. In cadrul testarilor efectuate pe animale s-a demonstrat ca administrarea de canabinoizi reduce hiperalgezia si alodinia asociata leziunilor nervoase induse de formalina si capsaicina, ca de altfel si durerea visceral persistent (5).
Se spera ca substantele canabinoide exogene (canabinoizii) ar putea fi o alternativa terapeutica pentru o serie de sindroame dureroase dificil de tratat. Doua din principalele obiective terapeutice sunt reprezentate de remiterea spasticitatii la bolnavii cu scleroza multipla si durerea neuropata rezistenta la terapia conventionala (5).
Alcaloidul in discutie, canabis sau marijuana, este folosit de peste doua mii de ani, atat ca analgetic, ca si in scop recreational. In Marea Britanie medicii au eliberat retete pentru marijuana pana in 1971, cand a fost oprita utilizarea sa in scopuri medicale, iar un studiu efectuat in 1994 arata ca 74% din medicii chestionati doresc reintroducerea marijuanei in farmacopee. Dezbaterea a inclus atat substanta naturala ce actioneaza asupra receptorilor canabinoizi, cat si canabinoizii sintetici. Nabilone este singurul canabinoid sintetic aprobat pentru uz clinic in Marea Britanie in terapia simptomatica a fenomenelor de greata, voma postchimioterapie. Delta-9- tetrahidrocanabinol (THC) este agonistul cel mai potent si este in uz clinic in Statele Unite (5)
Cannabis este folosit in scop recreational, in primul rand datorita efectului euforizant pe care il produce, dar efectele adverse psihologice induse de canabinoizi pot limita folosirea lor in terapia durerii (ex. afectarea functiilor psihomotorii si cognitive, anxietate, atacuri de panica , psihoze acute si paranoia). Alte efecte adverse presupun: uscaciunea gurii, tulburari de vedere, palpitatii, tahicardie, hipotensiune posturala, etc. (5).
O decizie in legatura cu introducerea canabinoizilor in clinic trebuie fundamentata de date clinice relevante in ceea ce priveste eficacitatea si tolerabilitatea produsilor folositi.
Autorii englezi ai studiului publicat de BMJ in vara acestui an au revizuit literatura de specialitate intre anii 1966- 1999 si s-au oprit la evaluarea a 9 studii clinice semnificative din punct de vedere statistic in care s-a analizat comportarea a patru produsi canabinoizi: THC oral: 5-10 mg, un analog nitrogenat al THC (NIB)-4 mg per os, benzopiranopiridina (BPP) per os si levonantradol 1,5-3 mg intramuscular. Nici unul din studii nu a luat in discutie marijuana inhalata sau fumata . Efectele analgetice au fost comparate cu 50-120 mg codeina per os si 50 mg secobarbital. Rezultatele acestor studii sugereaza ca efectul analgetic al dozei unice de canabinoizi este minim in durerea nociceptiva. In 8/9 studii canabinoizii per os au fost superiori placebo ca efect analgetic, dar nu mai eficace decat 50- 120 mg codeina. In doua trialuri clinice levonantradol a fost superior placebo, dar nu si codeinei pentru durerea postoperatorie, fapt care face imposibila utilizarea sa pentru durerea postoperatorie moderata sau severa (5).
Cat priveste utilizarea canabinoizilor pentru durerea cronica si neoplazica lipsesc in literatura de specialitate trialuri clinice pe loturi mari de bolnavi. In 5 din aceste studii efectul analgetic al dozei unice de canabinoizi este similar celui indus de codeina, dar utilizarea lor este limitata de efecte adverse care cresc in intensitate paralel cu dozajul (5).
Nu exista studii referitoare la rolul marijuanei administrata pe cale inhalatorie in terapia durerii.
Dintre efectele adverse cel mai frecvent s-a semnalat depresia sistemului nervos central, efectele cardiovasculare fiind de cele mai multe ori usoare si, in general, bine tolerate. Dintre canabinoizi sedarea si ametelile induse de Levonantradol au fost apreciate ca moderate pana la severe la peste 50% din pacienti. THC 5 mg nu da reactii adverse, in timp ce la 10- 20 mg p.o. apar fenomene de depresie a sistemului nervos central direct proportionale cu doza. Analogul nitrogenat al THC are efecte adverse similare codeinei si efecte sedative similare secobarbitalului, fara insa sa se poata demonstra contibutia componentei sedative la efectul analgetic al produsului (5).
Ce se poate afirma la final este faptul ca efectul analgetic maxim ce se poate obtine dupa o doza unica de canabinoizi este similara la 60 mg de Codeina (efect analgetic mai slab comparativ cu antiinflamatoarele nesteroidiene sau alte analgetice minore). Efectul analgetic creste cu escaladarea dozelor, dar cu pretul cresterii intensitatii reactiilor adverse.
Se poate concluziona pe baza datelor existente in literatura ca nu exista la aceasta ora fundamentare stiintifica pentru a sprijini introducerea canabinoizilor in schemele de terapia durerii (5).
1 Receptorii canabinoizi
Pana in prezent au fost descoperiti doi receptori canabinoizi (CB1 și CB2), care au putut fi clonați, in timp ce alți doi, WIN și canabidinol-anormal (abn-CBD) (ultimul este cunoscut și ca receptor pentru anandamida) au fost doar caracterizați farmacologic (1). Mai exista o varianta izoforma a CB1, CB1A a carei funcție nu se cunoaște (1).
Receptorii
canabinoizi aparțin familiei receptorilor legați cu proteinele G.
Acești receptori sunt caracterizați prin 7 domenii transmembranare, o
terminație extracelulata NH2 și o terminație
intracelulata COOH. O proteina G este o proteina trimerica
ce folosește guanozin trifosfat ca sursa de energie. Receptorii
canabinoizi sunt cuplați cu o proteina Gi. Cand este
activata proteina Gi, inhiba enzima adenilat ciclaza. La
randul, ei adenilat ciclaza nu mai poate forma cAMP. Scaderea
concentrației de cAMP este o consecința a stimularii
receptorilor canabinoizi.
Receptorii CB1 exista sub diferite forme conformationale, care ar putea determina care dintre mecanismele transducției este activat. Prezența receptorilor CB1 este limitata in mare parte la neuroni, iar exprimarea acestora este crescuta, ca și pentru receptorii opioizi, la nivelul catorva locații importante pentru procesarea nociceptiva in creier, maduva și sistemul nervos periferic. Receptorii CB1 au o prezența crescuta in cortex, ganglionii bazali, hipocamp, cerebel, și prezinta nivele scazute in nucleii trunchiului cerebral. De asemenea ei mai sunt prezenți in celulele substanței cenușii periapeductale (PAG) din mezencefal și in substanța gelatinoasa de la nivelul maduvei (primind informații nociceptive de la neuronii aferenți primari), doua puncte cheie in modularea informației nociceptive. Receptorii CB1 de la nivelul cornului posterior se gasesc predominant in interneuroni mai ales intr-o banda dubla de imunoreactivitate a receptorilor CB1 I, II, III și X. Receptorii CB1 se gasesc numai pe un procent mic de fibre C, in timp ce majoritatea se afla pe axonii cu diametru mare a fibrelor A mielinizate. Distribuția anatomica a receptorilor CB1 reflecta functia acestora de a modula percepția durerii atat la nivel periferic cat si la nivel central (18).
Prezența receptorilor CB2 este restricționata in mare parte la nivelul celulelor sistemului imun (1). Receptorii CB2 se gasesc pe celulele sistemului imun, cum ar fi macrofagele, limfocitele T și celulele NK. Dozele mari de canabinoizi supreseaza sistemul imun, in timp ce dozele mici duc la stimularea metabolica a limfocitelor. Mecanismul imunomodularii realizata de canabinoizi este inca neclar, dar dovezile sugereaza ca receptorii CB2 mediaza majoritatea acestor efecte.
Receptorii canabinoizi și endocanabinoizii sunt prezenți pe circuitele durerii de la terminatiile nervoase senzitive periferice pana la nivelul creierului. Receptorii CB1 sunt implicați in atenuarea transmisiei sinaptice, și o parte a efectului analgezic periferic a endocanabinoizilor poate fi atributa unui mecanism neuronal acționand prin intermediu receptorilor CB1 exprimați de neuronii aferenți primari. Descoperiri recente plaseaza receptorii CB1 și in celulele mastocitare conferindu-le unele afecte antiinflamatorii. Astfel receptorii CB1 activați din celulele mastocitare induc creșterea susținuta a cAMP, care la randul ei supreseaza degranularea (18).
Cu toate ca receptorii CB2 au fost asociați tradițional cu efectele periferice ale canabinoizilor (in special cu modularea raspunsurilor imunologice), aceștia contribuie și la efectele antinociceptive prin inhibarea eliberarii mediatorilor inflamatori de la nivelul celulelor aflate in apropierea terminațiilor nociceptive neuronale. Receptorii CB2 sunt exprimați in cateva tipuri de celule inflamatorii și imunocompetente. Din acest motiv activarea receptorilor CB2 periferici genereaza raspunsuri antinociceptive in situațiile hiperalgeziei inflamatorii și a durerii neuropatice, in timp ce agoniștii selectivi ai receptorilor CB2 s-au dovedit a nu avea proprietați antihiperalgice in durerea inflamatorie la experimentele pe animale. Prin urmare, din moment ce activarea receptorilor CB1 este asociata cu efecte adverse centrale incluzand ataxia și catalepsia, agoniștii selectivi ai receptorilor CB2 au potențialul de a trata durerea fara a exercita efecte adverse centrale (24)
Fenomenul "wind-up"
Wind-up este un raspuns neuronal exagerat care are loc in urma stimularii nocive repetate. Acest fenomen apare la sinapsa dintre neuronul primar aferent și neuronul spinotalamic. Aceasta sensibilizare duce la mai multi neurotransmițatori la nivelul acestei sinapse permițand o mai buna transmitere a semnalelor dureroase spre neuronul spinotalamic și spre creier. Nu exista tratamente satisfacatoare pentru durerea din bolile ce nu prezinta dovezi ale unor anormalitați in periferie (cum ar fi durerea miofasciala, sindromul intestinului iritabil și fibromialgia). Aceste boli pot fi manifestari ale unui mecanism de sensibilizare central exagerat sau wind-up. Administrarea sistemica a agoniștilor receptorilor CB1 exercita efecte analgezice asupra fenomenului wind-up (provocat prin stimulare transcutana) la nivelul cornului posterior. Administrarea intretecala de agoniști canabinoizi produc de asemenea analgezie, indicind o acțiune antinociceptiva la nivel spinal (24)
2 Endocanabinoizii
Spre deosebire de alti neurotransmitatori, anandamida nu este stocata in vezicule ci este eliberata de celule "la cerere" printr-un stimularea precursorilor fosfolipidici. S-a demonstrat ca biosinteza anandamidei are loc in diferite tipuri de celule de exemplu neuroblastomere, macrofage, bazofile, arterele mezenterice. Se pare ca astrocitele nu sunt implicate in sinteza AEA. La stimularea receptorilor dopaminergici D2-like la sobolani, s-a constatat eliberarea anandamidei dar nu si a 2-AG. In schimb, stimularea fibrelor de tip glutamat de la nivelul hipocampului nu a dus la cresterea concentratiilor de anandamida ci a determinat cresterea concentratiei de 2-AG (24).
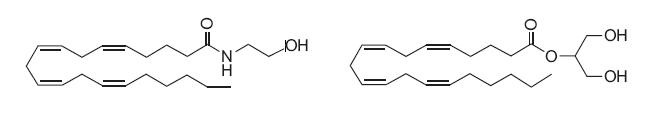
Fig. Structurile chimice ale anandamidei (stg.) si 2-AG (dr.)
Sursa
La inceputul anilor '80 Schmid si colaboratorii au descries calea de sinteza a N-aciletanolaminei. Potrivit acestei scheme, aciletanolamidele, incluzand AEA si linoleoiletanolamida sunt rezultate in urma activitatii fosfodiesterazei si a proceselor de N-acetilare (24).
In creier, acidul arahidonic este cuplat cu etilendiamina, formand arahidoniletilenamida (anandamida), substanta care la ora actual este considerata un agonist fiziologic al receptorilor canabinoizi. Prin intermediul receptorilor canabinoizi actioneaza tetrahidrocanabinona, substanta continuta in Canabis indica (canepa indiana), planta foarte cunoscuta ca "drog de strada" sub numele de hasis sau marijuana (13).
Anandamida are un timp de injumatatire foarte scurt, fiind repede captata de celule printr-un mecanism transportor, fie fiind metabolizata (13).
Pe langa posibilele efecte specifice actionarii receptorilor canabinoizi, anandamida pare sa fie de asemenea precursorul unor alte substante biologic active, cunoscute sub numele de prostamide (24).
Pana la ora actuala, nu sunt cunoscute foarte clar nici efectele prostamidelor, nici receptorii prin intermediul carora actioneaza. In orice caz, par sa fie receptori specifici, diferiti de receptorii pentru prostaglandine. Este poate interesant de mentionat ca anandamida si probabil si derivatii ei, nu exista numai la nivel cerebral, ci si in periferie. Un organ foarte bogat in anandamida este, de exemplu, uterul (13).
Se considera ca sunt doua surse principale de anandamida: eliberarea ei prin scindarea fosfolipidelor si sinteza de novo. La nivel membranar exista o fosfolipida particulara: N-arahidonil fosfatidiletanolamina, a carei sinteza porneste de la fosfolipide ordinare, intre care are loc o reactie de transacilare, prin desprinderea unei grupari arahidonil si transferul ei pe restul etanolaminic al unei alte molecule de fosfolipid. In conditiile activarii celulare, cand creste nivelul de ioni de calciu din citoplasma, o forma specific de PLD (fosfolipaza D) devine operanta, scindand acest fosfolipid cu formare de anandamida si acid fosfatidic. Cealalta sursa, considerata mai putin importanta cantitativ, este sinteza direct din arahidonat si colamina, catalizata de FAAH (fatty acid-amido hidrolaze), o enzima care poate actiona si in sens invers descompunand anandamida (18).
Celalalt endocanabinoid important, 2-arahidonil-glicerolul, se formeaza in mai multe etape din fosfolipidele membranare obisnuite. De regula, mai intai are loc scindarea gruparii fosfat cu formarea de DAG (enzima responsabila de acest process este o PLC), iar apoi prin interventia unei DAG lipase rezulta compusul biologic active (12).
Mediatorii sintetizati traverseaza usor membranele celulare, datorita caracterului lor lipofil, iar dupa ce actioneaza pe receptori sunt recaptati in celula unde sunt inactivati prin metabolizare. S-a descoperit ca recaptarea necesita un transportor active, usor saturabil cu analogi ai canabinoidelor endogene. Astfel se poate mari activitatea agonistilor canabinoizi prin inhibarea recaptarii lor, observatie cu posibile implicatii clinice (12).
Metabolizarea canabinoizilor se face predominant de catre enzima FAAH, care prezinta o dubla specificitate interesanta, fiind o amidaza, dar si o esteraza scindand 2AG cu o afinitate mai mare decat pentru anandamida. Anandamida serveste, intr-o mica masura, ca substrat enzimelor care realizeaza sinteza eicosanoidelor; astfel pe calea lipooxigenazei si a oxidazelor dependente de citocromul P450, in PMN si trombocite, se sintetizeaza hidroxi-anandamida (predomina derivatul 12 hidroxilat) care are inca o afinitate apreciabila pentru receptorii CB, fiind insa mai rezistenta la degradare; pe calea ciclooxigenazei, se presupune ca s-ar forma, in unele tesuturi, etanolamide ale prostaglandinelor, a caror semnificatie functionala nu este cunoscuta (18).
Primul derivat obtinut, R-metanandamida, s-a dovedit a fi doar partial specific pentru receptorul CB1 dar are o afinitate de 4 ori mai mare decat anandamida pe acest receptor si este mai rezistent la degradare enzimatica. Primii compusi cu adevarat selectivi obtinuti sunt ACPA (arahidonil-ciclopropilamida) care are o afinitate de 325 de ori mai mare pentru receptorul CB1, decat pentru receptorul CB2 si ACEA (arahidonil-2-cloretilamida) de 1400 de ori mai activa pe pe receptorul CB1. Situatia agonistilor specifici CB2 nu este la fel de buna, existand doar compusi partiali selectivi: canabidiolul este de cca. 3,8 ori mai selectiv pentru CB2 dar are si o potenta foarte mica, WIN 55212-2 un aminoalchil indol sintetic este de 28 de ori mai activ pe receptorii CB2, cel mai selectiv fiind insa JWH015, tot un derivat de sinteza care este de 38 de ori mai activ pe receptorii de tip 2, dar are dezavantajul unei potente mari pe ambele tipuri de receptori (12).
Primul compus la care s-a pus in evidenta o oarecare actiune antagonista pe receptorii CB a fost in mod surprinzator un derivat de AINS, si anume indometacin morfolinamida (12).
Mai tarziu s-au sintetizat si antagonisti specifici, care din punct de vedere structural sunt derivati de aril-pirazol.
Efectele canabinoidelor sunt foarte numeroase si ofera multiple posibilitati de utilizare clinica. La nivelul hipocampusului canabinoidele au efecte defavorabile asupra invatarii, si a memoriei de scurta durata, inhiband eliberarea de acetilcolina (desi la doze mici s-au descris efecte favorabile asupra sistemului acetilcolinergic) S-au raportat: efecte psihotomimetice, hipotermie (hipotalamus), inhibarea eliberarii dopaminei din striat, activarea axului hipotalamo-hipofizo-corticosuprarenalian, antagonizarea secretiei de prolactina. Se considera ca mediatorii canabinoizi au un rol important dar inca neprecizat in ontogeneza creierului, ei fiind absenti in copilarie si aparind doar odata cu avansarea in varsta (18).
Receptorii CB prezenti in numar mare in uter au efecte defavorabile implantarii embrionului, iar la barbat s-au raportat scaderea fertilitatii in urma consumuli cronic de canabis. Efectele exercitate asupra imunitatii sunt in general de tip supresor si afecteaza mai ales imunitatea umorala si cea citotoxica directa, fiind mediata specific prin receptorii CB2, ceea ce ofera sperante pentru utilizarea agonistilor specifici in bolile autoimmune (24).
Singurele deficiente previzibile ar fi necesitatea administrarii cronice si efecte psihotice reziduale (18).
Anandamida produce vasodilatatie si bradicardie prin intermediul unui receptor CB1, desi exista dovezi privind actiunea ei si pe receptorii vaniloizi, care pot induce la rindul lor relaxare vasculara. Concentratiile la care a fost observata legarea de receptorii VR-1 in vitro fiind destul de ridicate, exista dubii daca acest fenomen are vreo importanta fiziologica. Se considera ca anandamida dar mai ales arahidonil-glicerolul, reprezinta in unele tesuturi cel putin, acel factor endotelial hiperpolarizant (EDHF) responsabil de relaxarea vasului precontractat. Tot efectul hipotensiv ar putea fi implicat in scaderea presiunii intraoculare, efect exploatat deja in glaucoma (24).
In tubul digestiv receptorii CB1 inhiba motilitatea si reduc secretia de acid indusa de pentagastrina si acetilcolina dar nu si cea indusa de histamina, deasemnea produc antiemeza prin interventia la nivelul neuronilor chemosenzitivi din trunchiul cerebral (24).
Endocanabinoizii au inhibat puternic proliferarea in vitro a celulelor provenite din cancere de sin, probabil prin blocarea sitezei receptorului prolactinei.
Intre opioide si canabinoide exista multe elemente comune, atat in ceea ce priveste efectele (analgezie, hipotermie, halucinatii, dependenta, hipotensiune, inhibarea motilitatii gastrice) , cat si in ce priveste mecanismele de actiune. Astfel de curand s-a descris efectul dependentei de morfina la soarecele knock-out pentru gene CB1. Acesta nu si-a autoadministrat drogul in experimentele de dependenta, in timp ce autoadministrarea nu a fost afectata in cazul cocainei sau al amfetaminei. Explicatia acestui fapt ar fi incapacitatea morfinei de a determina eliberarea de dopamina la nivelul cortexului mezolimbic, conditie sine qua non a comportamentului de autosatisfacere. Aceasta descoperire indica noi cai de interventie terapeutica in tratamentul dependentelor farmacologice. Alte interactiuni intre aceste sisteme au loc la nivelul functiilor imune, toleranta aparuta la efectele imunosupresive ale unui mediator fiind incrucisata cu celalalt (24).
Mecanismele prin care se realizeaza analgezia canabinoida par a fi, in multe privinte, paralele sistemelor autoanalgezice opioide. S-a descris o componenta canabinoida la nivelul substantei cenusii periapeductale (zona opioida privilegiata), care potenteaza analgezia via un mecanism ce implica receptorii mGlu5. Se cunoaste si o cale canabinoida pornind de la nivelul maduvei rostro ventromediale, o alta zona considerata in trecut eminamente opioida, si care intervine probabil in analgezia spinala. Prezenta receptorilor canabinoizi in periferie si rolul lor antinociceptiv la acest nivel este sustinuta de descoperirea ca gelurile de anandamida si palmitoiletanolamida aplicate la soboloani au imbunatatit scorurile dureroase in testele de hiperalgezie indusa cu carageenan sau formalina (24).
4. DIETILAMINA-DATE GENERALE PRIVIND PROPRIETATILE FIZICO-CHIMICE SI TOXICITATEA ACESTEIA
Dietilamina este o amina secundara cu structura moleculara CH3CH2NHCH2CH
Din punct de vedere al proprietatilor fizice si chimice mentionam:
Este un lichid alcalin, inflamabil, miscibil cu apa si cu etanolul, de culoare brun inchisa datorita impuritatilor, iar prin distilare devine incolor. Este volatil si are un miros neplacut.
In combinatii cu acizii, mercurul si agentii oxidanti poate provoca reactii violente (25).
Greutatea moleculara 73,14; punctul de fierbere la 760 mmHg este 55.5 sC; densitatea vaporilor 2,5; punct de topire -50sC (20).
In ceea ce priveste efectele sale toxice:
La oameni dietilamina are actiune coroziva a ochilor, mucoaselor si pielii. Lichidul patruns accidental in ochi provoaca o durere severa si afectare corneana cu scaderea permanenta a acuitatii vizuale.
Expunerea prelungita si repetata la vapori cu concentratii sub nivelul iritant, produce edem cornean, vedere incetosata si fosfene. Contactul cu pielea duce la necrozarea acesteia.
Expunerea la concentratii mari ale vaporilor provoaca tuse severa, dureri in piept si edem pulmonar (20).
Ingestia acestei substante afecteaza tractul gastrointestinal producand durere severa, senzatie de greata si voma, diaree sau perforatii ale stomacului sau esofagului (20).
Expunerea acuta: Prin inhalarea vaporilor provoaca lacrimarea si roseata ochilor, edem cornean, dureri de cap, ameteala, anxietate, iritarea nasului, gatului, plamanilor cu dificultati in respiratie si tuse. La contactul cu pielea produce dermatite iritative (20).
Expunerea cronica: Dermatitele si afectarea pulmonara cronica sunt cele mai frecvente.
Dietilamina este cunoscuta ca si solvent folosit in diverse experimente chimice de laborator, in special in chimia organica. Riscurile expunerii profesionale la aceasta substanta a impus efectuarea unor serii de teste care sa evalueze toxicitatea dietilaminei (20).
In literatura de specialitate, exista teste efectuate pe animale pentru demonstrarea toxicitatii acute a dietilaminei. Cele mai multe dintre experimente au fost realizate pe soareci si sobolani.
Este important de retinut ca toxicitatea acuta a dietilaminei a fost similara la ambele specii (in jur de 500-600 mg/kg), ceea ce sugereaza doua aspect importante:
Si la administrarea orala si la cea intraperitoneala toxicitatea s-a instalat la aceleasi valori de 500-600 mg/kg, ceea ce sugereaza ca substanta s-a absorbit complet dupa administrarea orala;
cel putin la 2 specii de animale, nu exista particularitati farmacocinetice dependente de specie.
In literatura de specialitate nu exista date despre farmacocinetica dietilaminei administrata ca medicament la om sau la animale dar se considera ca nu exista particularitati ale farmacocineticii dependente de specie (15).
Faptul ca dietilamina este absorbita bine de la nivelul intestinului inseamna ca aceasta traverseaza bine membranele biologice iar la nivelul sistemului nervos isi exercita un mecanism de actiune (15).
Conform ipotezelor sustinute de Patel VK, Venkatakrishna-Bhatt H, Patel NB1 Jindal MN, in lucrarea "Pharmacology of new glutarimide compounds", publicata in Biomed Biochim Acta. 1985;44(5):795-803, in care a aratat ca dupa administrarea orala a substantei, la sobolani, LD50 s-a instalat la 500 mg/kg, ei au demonstrate ca la doze foarte crescute, dietilamina produce o diminuare globala a activitatii psihomotorii (15).
Datele din literatura au aratat ca dietilamina este o substanta hidrosolubila, solubilitatea sa in apa la 25sC fiind de 1.106mg/l.
Se stie de asemenea ca dietilamina este produsa prin metabolizarea unor medicamente cum este disulfiramul, folosit ca tratament cronic in alcoolism, sau lidocaina, folosita ca anestezic local (15).
Studiile au demonstrat ca disulfiramul este capabil sa modifice cantitatea de substanta P de la nivel cerebral (articolul "Disulfiram Administration Affects Substance P-like Immunoreactive and Monoaminergic Neural Systems in Rodent Brain" publicat de James E. Marchand, Kenneth Hershman, M. S. Amarendra Kumar, Michael L Thompson, si Richard M. Kream, si publicat in "THE JOURNAL OF BIOLOGICAL CHEMISTRY", Vol. 265, Nr. 1, Editia 5 din Ianuarie, pag. 264-273, 1990). Disulfiramul produce dietilamina prin metabolizarea sa iar substanta P induce senzatia de durere. Totusi nu s-a demonstrat daca disulfiramul are sau nu efecte analgezice pentru ca acesta genereaza cantitati mult prea reduse de dietilamina (15).
Dietilamina este folosita ca excipient in unele preparate topice care contin diclofenac sau acid acetilsalicilic pentru a le creste absorbtia acestora prin piele. Daca dietilamina ar fi fost foarte toxica, folosirea ei ar fi fost interzisa (15).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |